جدول محتويات هذه المقالة:
1. تطوير الأحماض الأمينية
2. الخصائص الهيكلية
3. التكوين الكيميائي
4.Classing
5. التوليف
6. الخصائص الفيزيائية والكيميائية
7. السمية
8. نشاط مضادات الميكروبات
9. الخصائص الريولوجية
10. التطبيقات في صناعة مستحضرات التجميل
11. التطبيقات في مستحضرات التجميل اليومية
السطحي الأحماض الأمينية (AAS)هي فئة من السطحي التي تشكلت من خلال الجمع بين المجموعات مسعور مع واحد أو أكثر من الأحماض الأمينية. في هذه الحالة ، يمكن أن تكون الأحماض الأمينية اصطناعية أو مستمدة من هيدروليس البروتين أو مصادر متجددة مماثلة. تغطي هذه الورقة تفاصيل معظم الطرق الاصطناعية المتاحة لـ AAS وتأثير الطرق المختلفة على الخواص الفيزيائية والكيميائية للمنتجات النهائية ، بما في ذلك القابلية للذوبان واستقرار التشتت والسمية وقابلية التحلل الحيوي. باعتبارها فئة من السطحي في زيادة الطلب ، فإن تنوع AAS بسبب هيكلها المتغير يوفر عددًا كبيرًا من الفرص التجارية.
بالنظر إلى أن المواد السطحية تستخدم على نطاق واسع في المنظفات ، والمستحلبات ، ومثبطات التآكل ، واستعادة الزيت العالي والمستحضرات الصيدلانية ، لم يتوقف الباحثون عن الانتباه إلى السطحي.
تعتبر الفاعل بالسطح المنتجات الكيميائية الأكثر تمثيلا التي يتم استهلاكها بكميات كبيرة على أساس يومي في جميع أنحاء العالم وكان لها تأثير سلبي على البيئة المائية.وقد أظهرت الدراسات أن الاستخدام الواسع النطاق للسطح التقليدي يمكن أن يكون له تأثير سلبي على البيئة.
اليوم ، فإن عدم التسمم وقابلية التحلل الحيوي والتوافق الحيوي مهم للمستهلكين مثل فائدة وأداء السطحي.
المكورات الحيوية هي السطحي المستدامة الصديقة للبيئة والتي يتم تصنيعها بشكل طبيعي بواسطة الكائنات الحية الدقيقة مثل البكتيريا والفطريات والخميرة ، أو تفرز خارج الخلية.لذلك ، يمكن أيضًا تحضير العوامل الحيوية عن طريق التصميم الجزيئي لتقليد الهياكل الطبيعية الأمفيليك ، مثل الفسفوليبيد ، جليكوسيدات الألكيل والأحماض الأمينية الأسيل.
السطحي الأحماض الأمينية (AAS)هي واحدة من السطحي النموذجي ، والتي عادة ما يتم إنتاجها من المواد الخام أو الزراعية المشتقة. على مدار العقدين الماضيين ، اجتذبت AAS الكثير من الاهتمام من العلماء بصفتها سطحيًا جديدًا ، ليس فقط لأنه يمكن تصنيعها من الموارد المتجددة ، ولكن أيضًا لأن AAs قابلة للتحلل بسهولة ولديها منتجات ثانوية غير ضارة ، مما يجعلها أكثر أمانًا للبيئة.
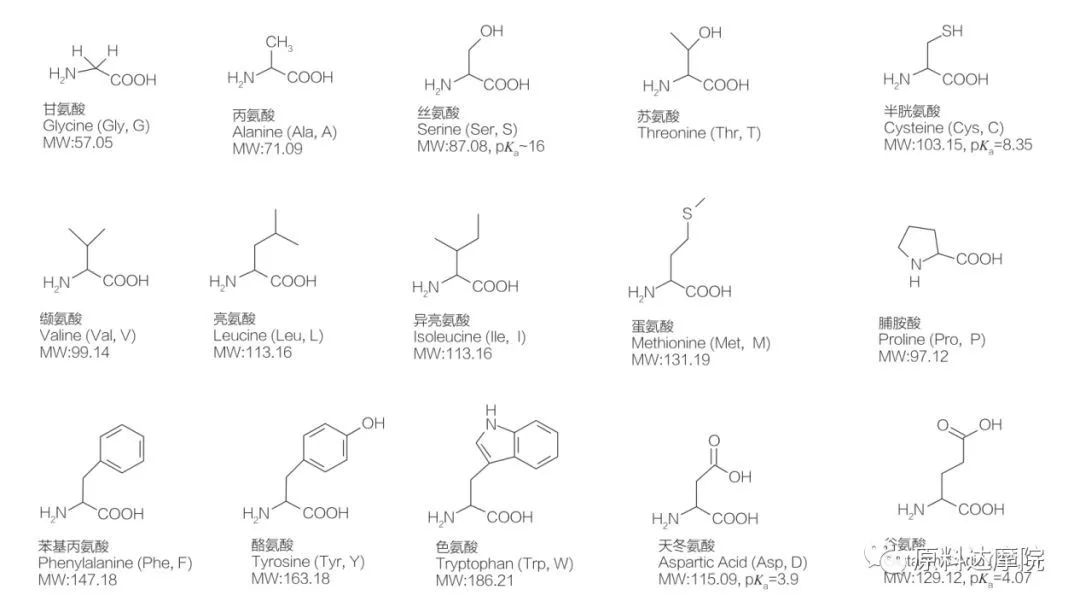
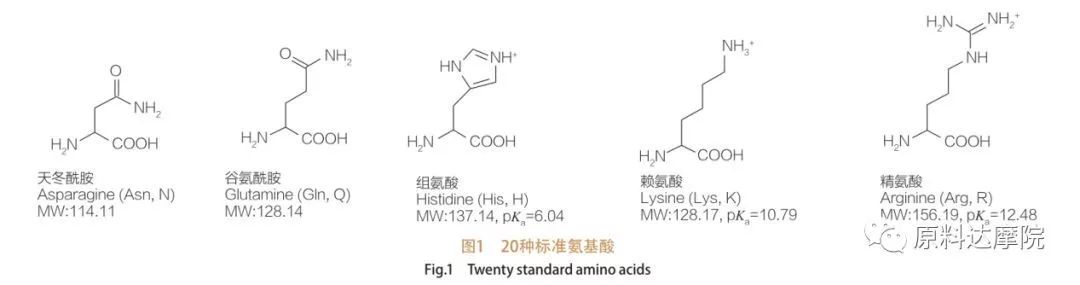
يمكن تعريف AAS على أنها فئة من السطحي تتكون من الأحماض الأمينية التي تحتوي على مجموعات الأحماض الأمينية (HO 2 C-CHR-NH 2) أو بقايا الأحماض الأمينية (HO 2 C-CHR-NH-). تتيح المناطق الوظيفية للأحماض الأمينية اشتقاق مجموعة واسعة من السطحي. من المعروف أن ما مجموعه 20 من الأحماض الأمينية البروتينية القياسية موجودة في الطبيعة وهي مسؤولة عن جميع التفاعلات الفسيولوجية في أنشطة النمو والحياة. إنها تختلف عن بعضها البعض فقط وفقًا للبقايا R (الشكل 1 ، PK A هو اللوغاريتم السلبي لتفكك الحمض من المحلول). بعضها غير قطبي وماء مسعور ، وبعضها قطبي وماء ، وبعضها أساسي وبعضها حمضي.
نظرًا لأن الأحماض الأمينية عبارة عن مركبات قابلة للتجديد ، فإن السطحي الذي يتم تصنيعه من الأحماض الأمينية لديهم أيضًا إمكانية عالية لتصبح مستدامة وصديقة للبيئة. غالبًا ما يجعلها الهيكل البسيط والطبيعي ، السمية المنخفضة والقابلية للتحلل الحيوي السريع ، متفوقة على السطحي التقليدي. باستخدام المواد الخام المتجددة (مثل الأحماض الأمينية والزيوت النباتية) ، يمكن إنتاج AAS عن طريق طرق التكنولوجيا الحيوية المختلفة والطرق الكيميائية.
في أوائل القرن العشرين ، تم اكتشاف الأحماض الأمينية لأول مرة لاستخدامها كركائز لتوليف السطحي.تم استخدام AAS بشكل أساسي كمواد حافظة في المستحضرات الصيدلانية ومستحضرات التجميل.بالإضافة إلى ذلك ، تم العثور على AAS لتكون نشطة بيولوجيا ضد مجموعة متنوعة من البكتيريا المسببة للأمراض والأورام والفيروسات. في عام 1988 ، ولدت توفر AAS منخفضة التكلفة مصلحة بحثية في النشاط السطحي. اليوم ، مع تطور التكنولوجيا الحيوية ، يمكن أيضًا تصنيع بعض الأحماض الأمينية تجاريًا على نطاق واسع من قبل الخميرة ، مما يثبت بشكل غير مباشر أن إنتاج AAS أكثر ملاءمة للبيئة.
01 تطوير الأحماض الأمينية
في وقت مبكر من أوائل القرن التاسع عشر ، عندما تم اكتشاف الأحماض الأمينية التي تحدث بشكل طبيعي لأول مرة ، كان من المتوقع أن تكون هياكلها ذات قيمة كبيرة - قابلة للاستخدام كمواد خام لإعداد الأمفيفيل. تم الإبلاغ عن الدراسة الأولى حول تخليق AAS من قبل Bondi في عام 1909.
في تلك الدراسة ، تم تقديم N-acylglycine و N-acylalanine كمجموعات محبة للماء للسطح. تضمن العمل اللاحق تخليق الأحماض الشحمية (AAS) باستخدام الجليسين والألانين ، و Hentrich et al. نشرت سلسلة من النتائج ،بما في ذلك تطبيق براءة الاختراع الأول ، حول استخدام أملاح الأسيل الأسيل والأسبارتات أسيل كقائد سطحي في منتجات التنظيف المنزلي (مثل الشامبو والمنظفات ومعدني الأسنان).بعد ذلك ، قام العديد من الباحثين بالتحقيق في التوليف والخصائص الفيزيائية والكيميائية للأحماض الأمينية الأسيل. حتى الآن ، تم نشر مجموعة كبيرة من الأدبيات على التوليف والخصائص والتطبيقات الصناعية وقابلية التحلل الحيوي لـ AAS.
02 الخصائص الهيكلية
قد تختلف سلاسل الأحماض الدهنية غير القطبية غير القطبية من AAs في البنية وطول السلسلة وعددها.إن التنوع الهيكلي والنشاط السطحي العالي لـ AAS يفسران تنوعها التركيبي الواسع والخصائص الفيزيائية والكيميائية والبيولوجية. تتكون مجموعات الرأس من AAS من الأحماض الأمينية أو الببتيدات. تحدد الاختلافات في مجموعات الرأس امتصاص وتجميع ونشاط بيولوجي لهذه السطحي. ثم تحدد المجموعات الوظيفية في مجموعة الرأس نوع AAs ، بما في ذلك الكاتيونات ، الأنيونية ، غير الأيونية ، والبرمائية. مزيج من الأحماض الأمينية المحبة للماء والأجزاء الطويلة مسعور تشكل بنية برمائية تجعل الجزيء نشطًا للغاية. بالإضافة إلى ذلك ، يساعد وجود ذرات الكربون غير المتماثلة في الجزيء على تكوين جزيئات chiral.
03 التكوين الكيميائي
جميع الببتيدات والببتيدات هي منتجات البلمرة من هذه الأحماض الأمينية α-proteinogenic حوالي 20 α. تحتوي جميع الأحماض الأمينية الـ 20 α على مجموعة وظيفية لأحماض الكربوكسيل (-COOH) ومجموعة وظيفية أمينية (-NH 2) ، وكلاهما متصل بنفس ذرة رباعي السطوح α-carbon. تختلف الأحماض الأمينية عن بعضها البعض بواسطة مجموعات R المختلفة المرتبطة بـ α-carbon (باستثناء Lycine ، حيث تكون مجموعة R هي الهيدروجين.) قد تختلف مجموعات R في التركيب والحجم والشحن (الحموضة ، القلوية). تحدد هذه الاختلافات أيضًا قابلية ذوبان الأحماض الأمينية في الماء.
الأحماض الأمينية هي chiral (باستثناء الجليكاين) وهي نشطة بصريًا بطبيعتها لأنها تحتوي على أربع بدائل مختلفة مرتبطة بكربون ألفا. الأحماض الأمينية لها مطابقة محتملة ؛ إنها صور مرآة غير متداخلة لبعضها البعض ، على الرغم من حقيقة أن عدد L-stereoisomers أعلى بكثير. مجموعة R الموجودة في بعض الأحماض الأمينية (فينيل ألانين ، التيروزين والتربوتوفان) هي أريل ، مما يؤدي إلى امتصاص الأشعة فوق البنفسجية القصوى عند 280 نانومتر. إن α-COOH الحمضية و α-NH 2 الأساسية في الأحماض الأمينية قادرة على التأين ، وكلا الاستريو ، أيهما ، يبنيان توازن التأين الموضح أدناه.
r-cooh ↔r-coo-+ ح+
r-NH3+↔r-NH2+ ح+
كما هو مبين في توازن التأين أعلاه ، تحتوي الأحماض الأمينية على مجموعتين حمضيتين على الأقل ؛ ومع ذلك ، فإن مجموعة الكربوكسيل أكثر حمضية مقارنة بمجموعة الأمينية البروتونية. الرقم الهيدروجيني 7.4 ، يتم إبطال مجموعة الكربوكسيل أثناء بروتوني المجموعة الأمينية. الأحماض الأمينية ذات المجموعات R غير القابلة للتأمين محايدة كهربائيًا في هذا الرقم الهيدروجيني وتشكل Zwitterion.
04 التصنيف
يمكن تصنيف AAS وفقًا لأربعة معايير ، الموضحة أدناه بدورها.
4.1 حسب الأصل
| وفقًا للأصل ، يمكن تقسيم AAS إلى فئتين على النحو التالي. ① الفئة الطبيعية بعض المركبات التي تحدث بشكل طبيعي تحتوي على الأحماض الأمينية لديها أيضًا القدرة على تقليل التوتر السطحي/البيني ، وبعضها يتجاوز فعالية الجليكوليبيد. تُعرف هذه AAS أيضًا باسم Lipopeptides. الشحوم هي مركبات الوزن الجزيئي منخفضة ، وعادة ما تنتجها أنواع العصوية.
هذه AAS تنقسم إلى 3 فئات فرعية:السطحي ، إيتورين وفنجيسين.
|
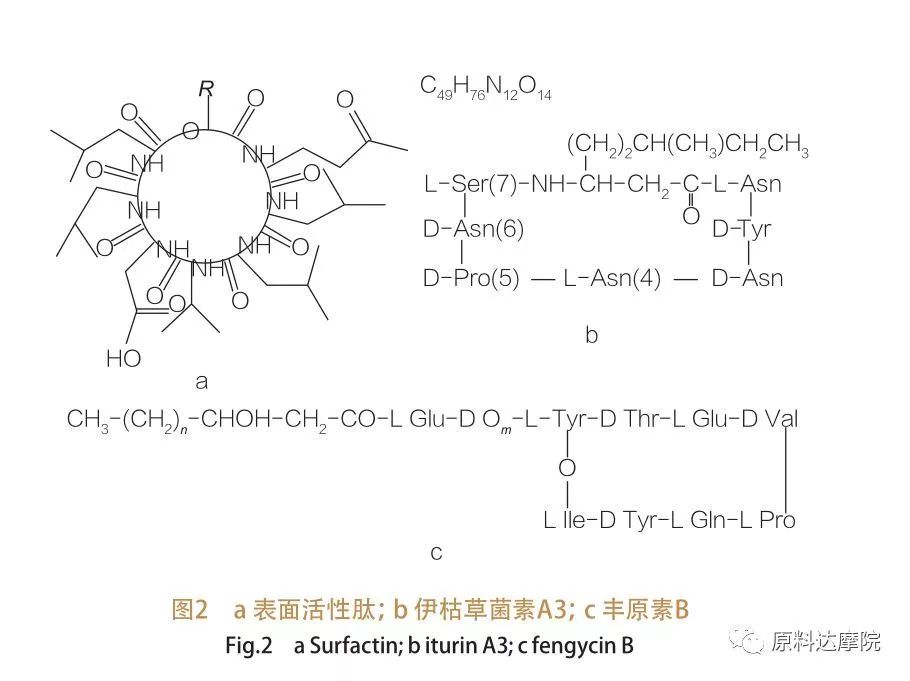
| تشمل عائلة الببتيدات النشطة السطحية متغيرات Heptapeptide لمجموعة متنوعة من المواد ،كما هو مبين في الشكل 2A ، حيث ترتبط سلسلة الأحماض الدهنية غير المشبعة C12-C16 بببتيد. الببتيد النشط السطحي هو لاكتون كبير في الدم يتم فيه إغلاق الحلقة عن طريق الحفز بين الطرف C من الأحماض الدهنية β-hydroxy والببتيد. في الفئة الفرعية من إيتورين ، هناك ستة متغيرات رئيسية ، وهي Iturin A و C ، و mycosubtilin و Bacillomycin D و F و L.في جميع الحالات ، ترتبط Heptapeptides بسلاسل C14-C17 من الأحماض الدهنية الأمينية (يمكن أن تكون السلاسل متنوعة). في حالة ekurimycins ، يمكن للمجموعة الأمينية في الموضع β تشكيل رابطة أميد مع C-terminus وبالتالي تشكل بنية اللاكتام الكلي.
يحتوي Fengycin الفرعي على Fengycin A و B ، والذي يسمى أيضًا plipastatin عندما يتم تكوين Tyr9.يرتبط Decapeptide بسلسلة الأحماض الدهنية المشبعة أو غير المشبعة β -hydroxy. من الناحية الهيكلية ، يعتبر plipastatin أيضًا لاكتونًا كبيرًا ، يحتوي على سلسلة جانبية Tyr في الموضع 3 من تسلسل الببتيد وتشكيل رابطة استر مع بقايا C-terminal ، وبالتالي تشكل بنية حلقة داخلية (كما هو الحال بالنسبة للعديد من الببتيدات البسيدوموناس).
② فئة الاصطناعية يمكن أيضًا تصنيع AAS باستخدام أي من الأحماض الأمينية الحمضية والأساسية والمحايدة. الأحماض الأمينية الشائعة المستخدمة لتوليف AAs هي حمض الجلوتاميك ، السيرين ، البرولين ، حمض الأسبارتيك ، الجليسين ، أرجينين ، ألانين ، اللوسين ، والبروتين المائيات. يمكن تحضير هذه الفئة الفرعية من السطحي عن طريق الطرق الكيميائية والأنزيمية والكيميائية ؛ ومع ذلك ، بالنسبة لإنتاج AAS ، يكون التوليف الكيميائي أكثر جدوى اقتصاديًا. تشمل الأمثلة الشائعة حمض N-lauroyl-L-glutamic وحمض N-palmitoyl-L-glutamic.
|
4.2 استنادًا إلى بدائل السلسلة الأليفاتية
استنادًا إلى بدائل السلسلة الأليفاتية ، يمكن تقسيم السطحي القائم على الأحماض الأمينية إلى نوعين.
وفقا لموقف البديل
| ①n-substituted AAS في مركبات N-substituted ، يتم استبدال مجموعة أمينية بمجموعة من الدهون أو مجموعة الكربوكسيل ، مما يؤدي إلى فقدان الأساسيات. إن أبسط مثال على AAs n-substituted هو الأحماض الأمينية N-acyl ، والتي هي أساسا السطحي الأنيوني. AAs n-substituted لها رابطة أميد متصلة بين الأجزاء الكارهة للماء والماء. يتمتع رابطة Amide بالقدرة على تكوين رابطة هيدروجين ، مما يسهل تدهور هذا الفاعل بالسطح في بيئة حمضية ، مما يجعله قابلاً للتحلل.
②c-substituted AAS في المركبات C-substitited ، يحدث الاستبدال في مجموعة الكربوكسيل (عبر رابطة أميد أو استر). المركبات النموذجية C-substituted (على سبيل المثال استرات أو Amides) هي أساسا السطحي الكاتيوني.
③n- و C-substited AAS في هذا النوع من الفاعل بالسطح ، كل من مجموعات الأمينية والكربوكسيل هي الجزء المحبب. هذا النوع هو في الأساس سطحي برمامي. |
4.3 وفقًا لعدد ذيول الكارهة للماء
بناءً على عدد مجموعات الرأس والذيل مسعور ، يمكن تقسيم AAs إلى أربع مجموعات. سلسلة AAS المستقيمة ، الجوزاء (Dimer) من النوع AAS ، Glycerolipid Type AAS ، و Bicephalic البرمائي (BOLA) من النوع AAS. السطحي السلسلة المستقيمة هي السطحي التي تتكون من الأحماض الأمينية مع ذيل مسعور واحد فقط (الشكل 3). يحتوي Gemini Type AAS على مجموعتين من الرأس القطبي من الأحماض الأمينية وذيذان مسعور لكل جزيء (الشكل 4). في هذا النوع من الهيكل ، يتم ربط AAs سلسلة مستقيمة معًا بواسطة فاصل وبالتالي يسمى أيضًا Dimers. من ناحية أخرى ، يتم ربط ذيول الكارهة للماء Glycerolipid ، من ناحية أخرى ، على نفس مجموعة رأس الأحماض الأمينية. يمكن اعتبار هذه الفاعل بالسطح من النظريات من monoglycerides و diglycerides و phospholipids ، بينما في AAS من نوع بولا ، ترتبط مجموعتان من رأس الأحماض الأمينية بواسطة ذيل مسعور.
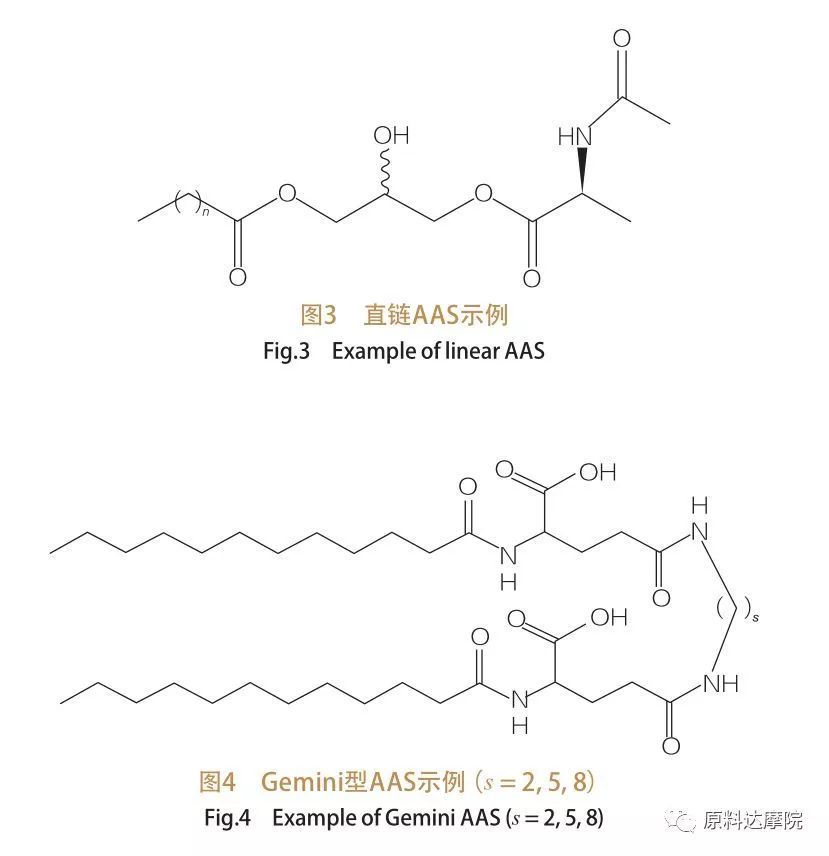
4.4 وفقًا لنوع مجموعة الرأس
AAS AAS
مجموعة الرأس من هذا النوع من الفاعل بالسطح لديها شحنة إيجابية. أقدم AAS الكاتيون هو إيثيل كوكويل ، وهو كربوكسيل بيروليدون. الخصائص الفريدة والمتنوعة لهذا الفاعل بالسطح تجعلها مفيدة في المطهرات ، والعوامل المضادة للميكروبات ، والعوامل المضادة للكلمة ، ومكيفات الشعر ، فضلاً عن كونها لطيفة على العينين والجلد القابلة للتحلل بسهولة. قام Singare و Mhatre بتوليف AAs الكاتيون القائم على أرجينين وتقييم خصائصها الفيزيائية والكيميائية. في هذه الدراسة ، ادعوا عوائد عالية من المنتجات التي تم الحصول عليها باستخدام ظروف رد فعل Schotten-Baumann. مع زيادة طول سلسلة الألكيل والوقاية من مسعور ، تم العثور على النشاط السطحي للسلاح السطحي لزيادة وتركيز micelle الحرج (CMC) لتقليل. واحد آخر هو بروتين الأسيل الرباعي ، والذي يستخدم عادة كمكيف في منتجات العناية بالشعر.
②anionic AAS
في الفاعل السطحي الأنيوني ، فإن مجموعة الرأس القطبية من الفاعل بالسطح لديها شحنة سلبية. يرتبط الساركوسين (CH 3 -NH -CH 2 -COOH ، N -Methylglycine) ، وهو حمض أميني شائع في قنافذ البحر ونجوم البحر ، كيميائيًا بالجليسين (NH 2 -CH 2 -COOH ،) ، وهو حمض أميني أساسي موجود في خلايا الثدييات. يرتبط Cooh ،) كيميائيًا بالجليسين ، وهو حمض أميني أساسي موجود في خلايا الثدييات. يشيع استخدام حمض اللوريك ، وحمض رباعي الكانويك ، وحمض الأوليك وهاليداتها واستراتها لتوليف السطح السطحي الساركوزينات. الساركوزينات معتدلة بطبيعتها ، وبالتالي فهي شائعة الاستخدام في غسالات الفم ، والشامبو ، ورغاوي حلاقة الرش ، واقي من الشمس ، ومنظفات الجلد ، وغيرها من المنتجات التجميلية.
وتشمل AAS الأنيون الأخرى المتاحة تجاريا AAS Amisoft CS-22 و AmiliteGCK-12 ، وهما أسماء تجارية لـ Sodium N-Cocoyl-L-Glutamate و N-Cocoyl Glycinate ، على التوالي. يستخدم Amilite عادة كعامل رغوة ، ومنظفات ، وذوبان ، ومستحلب ، ومشتت ، ولديه العديد من التطبيقات في مستحضرات التجميل ، مثل الشامبو ، وصابون الحمام ، وغسل الجسم ، وأجراس الأسنان ، ومطهرات الوجه ، وصابون التطهير ، وعلاج العدسات اللاصقة والقطاع السطحي المنزلي. يتم استخدام Amisoft كمنظف معتدل للجلد والشعر ، وخاصة في منظفات الوجه والجسم ، ومنظفات تركيبية ، ومنتجات رعاية الجسم ، والشامبو وغيرها من منتجات العناية بالبشرة.
③zwitterionic أو AAS الأمفوتة
تحتوي السطحي على كلاً من المواقع الحمضية والأساسية ، وبالتالي يمكن أن تغير شحنتها عن طريق تغيير قيمة الرقم الهيدروجيني. في وسائل الإعلام القلوية ، يتصرفون مثل السطحي الأنيوني ، بينما في البيئات الحمضية يتصرفون مثل السطحي الكاتيوني وفي الوسائط المحايدة مثل السطحي البرمامي. Lauryl Lysine (LL) و Alkoxy (2-hydroxypropyl) Arginine هما السطحيون الوحيدون المعروفين الأمفوتريين القائم على الأحماض الأمينية. LL هو منتج تكثيف من ليسين وحمض لوريك. نظرًا للهيكل الأمفوتري ، فإن LL غير قابل للذوبان في جميع أنواع المذيبات تقريبًا ، باستثناء المذيبات القلوية أو الحمضية. كمسحوق عضوي ، تتمتع LL بتصاق ممتاز للأسطح المحبة للماء ومعامل منخفض من الاحتكاك ، مما يمنح هذه القدرة على التشحيم الممتازة السطحي. يستخدم LL على نطاق واسع في كريمات البشرة ومكيفات الشعر ، ويستخدم أيضًا كمواد تشحيم.
④nonionic AAS
تتميز الفاعل بالسطح غير الأيوني بمجموعات الرأس القطبية بدون رسوم رسمية. تم تحضير ثمانية من السطحي غير السطحي غير الموسيقي من قبل Sabagh et al. من الأحماض α-amino القابلة للذوبان في الزيت. في هذه العملية ، تم إبداع L-phenylalanine (LEP) و L-leucine لأول مرة مع Hexadecanol ، تليها الوسط مع حمض النخيل لإعطاء اثنين من الأميركين واسترتين من الأحماض الأمينية α. خضعت الأميدات والاسترات بعد ذلك تفاعلات التكثيف مع أكسيد الإيثيلين لإعداد ثلاثة مشتقات فينيل ألانين مع أعداد مختلفة من وحدات البوليوكسي إيثيلين (40 و 60 و 100). تم العثور على هذه AAs غير أيونية لديها خصائص جيدة للمنظفات ورغوة.
05 توليف
5.1 المسار الاصطناعي الأساسي
في AAS ، يمكن توصيل المجموعات الكارهة للماء بمواقع أمين أو حمض الكربوكسيل ، أو من خلال السلاسل الجانبية للأحماض الأمينية. بناءً على ذلك ، تتوفر أربعة طرق اصطناعية أساسية ، كما هو موضح في الشكل 5.
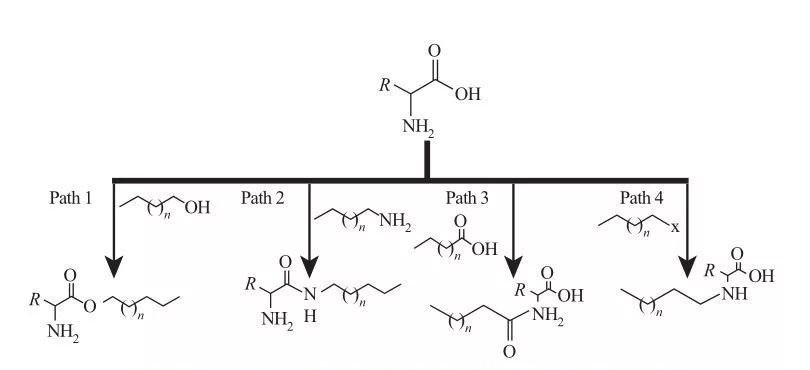
الشكل 5 مسارات التوليف الأساسية للسطحي القائم على الأحماض الأمينية
| المسار 1. يتم إنتاج أمينات الإستر البرمائي عن طريق تفاعلات الإستر ، وفي هذه الحالة يتم تحقيق تخليق الفاعل بالسطح عادة عن طريق ارتداد الكحول الدهني والأحماض الأمينية في وجود عامل تجفيف ومحفز حمضي. في بعض التفاعلات ، يعمل حمض الكبريتيك كحافز وعامل مجفف.
المسار 2. تتفاعل الأحماض الأمينية المنشطة مع ألكيلامينات لتشكيل روابط أميد ، مما يؤدي إلى توليف الأميدوين الأمفيلي.
المسار 3. يتم تصنيع أحماضها من خلال رد فعل مجموعات الأمين من الأحماض الأمينية مع الأحماض الأميدو.
المسار 4. تم تصنيع الأحماض الأمينية ألكيل طويلة السلسلة من خلال تفاعل مجموعات أمين مع هالوكان. |
5.2 التقدم في التوليف والإنتاج
5.2.1 تخليق السطحي الأحماض الأمينية/الببتيد أحادي السلسلة
يمكن تصنيع أحماض الأمينية N-acyl أو O-acyl أو الببتيدات عن طريق acylation المحفزة بالإنزيم من مجموعات الأمين أو الهيدروكسيل مع الأحماض الدهنية. استخدم التقرير الأول عن التوليف المحفز من الليباز الخالي من المذيبات من أميد الأحماض الأمينية أو مشتقات استرات الميثيل المبيضات في أنتاركتيكا ، مع عائد تتراوح بين 25 ٪ إلى 90 ٪ حسب الحمض الأميني المستهدف. كما تم استخدام ميثيل إيثيل كيتون كمذيب في بعض ردود الفعل. Vonderhagen et al. كما وصفت تفاعلات N-acylation التي تحفزها البروتياز من الأحماض الأمينية ، و/أو مشتقات البروتين و/أو مشتقاتها باستخدام مزيج من المذيبات والمذيبات العضوية (على سبيل المثال ، ثنائي ميثيل فورميد/الماء) والميثيل بوتيل كيتون.
في الأيام الأولى ، كانت المشكلة الرئيسية في تخليق الإنزيم المحفزة لـ AAS هي العائدات المنخفضة. وفقا لفاليفتي وآخرون. كان عائد مشتقات الأحماض الأمينية N-tetradecanoyl 2 ٪ إلى 10 ٪ فقط حتى بعد استخدام Lipases المختلفة والحضانة عند 70 درجة مئوية لعدة أيام. مونتيت وآخرون. واجهت أيضًا مشاكل تتعلق بانخفاض العائد للأحماض الأمينية في تخليق N-acyl ليسين باستخدام الأحماض الدهنية والزيوت النباتية. وفقًا لهم ، كان الحد الأقصى لعائد المنتج بنسبة 19 ٪ في ظل ظروف خالية من المذيبات واستخدام المذيبات العضوية. واجهت نفس المشكلة بواسطة Valivety et al. في تخليق مشتقات ميثيل ميثيل N-CBZ-L-Lysine أو N-CBZ-Lysine.
في هذه الدراسة ، ادعوا أن العائد من 3-O-tetradecanoyl-L-serine كان 80 ٪ عند استخدام سيرين محمية N كركيزة و Novozyme 435 كمحفز في بيئة خالية من المذيبات المنصهرة. درس Nagao و Kito acylation من L-serine ، L-homoserine ، L-threonine و L-tyrosine (دعنا) عند استخدام نتائج رد الفعل (تم الحصول على الليباز من قبل acylinds و lo-l-sine. acylation من L-threonine ودع الحدوث.
دعم العديد من الباحثين استخدام ركائز غير مكلفة ومتاحة بسهولة لتوليف AAs الفعالة من حيث التكلفة. سو وآخرون. ادعى أن تحضير السطحي القائم على زيت النخيل يعمل بشكل أفضل مع انزيم الشحوم. وأشاروا إلى أن عائد المنتجات سيكون أفضل على الرغم من رد الفعل المستغرق للوقت (6 أيام). جيروفا وآخرون. التحقيق في التوليف والنشاط السطحي لـ chiral n-palmitoyl AAs على أساس الميثيونين ، والبرولين ، والليوسين ، والثريونين ، والفينيل ألانين والفينيل جليسين في مزيج دوري/راكيمي. وصف PANG و CHU توليف المونومرات القائمة على الأحماض الأمينية والمونومرات القائمة على حمض الديكربوكسيل في محلول سلسلة من استرات البولي أميد الأمينية الوظيفية والقابلة للتحلل ، تم توليفها بواسطة تفاعلات التكثيف المشترك في المحلول.
أبلغت Cantaeuzene و Guerreiro عن استرخاء مجموعات حمض الكربوكسيل من BOC-ALA-OH و BOC-ASP-OH مع الكحول الأليفاتية الطويلة و diols ، مع ثنائي كلورو ميثان مثل المذيبات و agarose 4b (سيفاروز 4B) كمحفز. في هذه الدراسة ، أعطى تفاعل BOC-Ala-OH مع الكحول الدهني ما يصل إلى 16 كربونًا غلة جيدة (51 ٪) ، بينما كان BOC-ASP-OH 6 و 12 كربونات أفضل ، مع عائد مقابل قدره 63 ٪ [64]. 99.9 ٪) في العائدات التي تتراوح من 58 ٪ إلى 76 ٪ ، والتي تم تصنيعها من خلال تكوين روابط أميد مع مختلف الألكيلات ذات السلسلة الطويلة أو روابط استر مع الكحول الدهنية بواسطة CBZ-ARG-OME ، حيث تصرفت Papain كحافز.
5.2.2 تخليق السطحي الأحماض الأمينية القائمة على الجوزاء/الببتيد
تتكون السطحي Gemini القائم على الأحماض الأمينية من جزيئين AAS على التوالي المرتبطين ببعضهما البعض من قبل مجموعة فاصل. هناك مخططان محتملان للتخليق الكيميائي للقطاع السطحي القائم على الأحماض الأمينية من النوع الجوزاء (الشكلان 6 و 7). في الشكل 6 ، يتم تفاعل مشتقات الأحماض الأمينية 2 مع المركب كمجموعة فاصل ثم يتم إدخال مجموعتين مسعورتين. في الشكل 7 ، ترتبط الهياكل ذات السلسلة المستقيمة بشكل مباشر معًا بواسطة مجموعة فاصل ثنائي الوظيفة.
كان التطور الأول لتوليف الإنزيم المحفز للأحماض الشحمية الجوزاء رائدة من قبل Valivety et al. يوشيمورا وآخرون. التحقيق في التوليف وامتصاص وتجميع السطحي الجوزاء القائم على الأحماض الأمينية يعتمد على السيستين وبروميد N-alkyl. وتمت مقارنة الفاعل بالسطح الموضعي مع السطحي الأحادي المقابل. فاوستو وآخرون. وصف توليف AAs المونومريك القائم على اليوريا القائم على L-cystine ، D-cystine ، DL-cystine ، L-cysteine ، L-methionine و L-sulfoalanine وأزواجها من الجوزاء عن طريق التوصيل ، توتر التوازن السطحي وتمييز الفلورة المستقرة للمادة. وقد تبين أن قيمة CMC للجوزاء كانت أقل من خلال مقارنة المونومر والجوزاء.
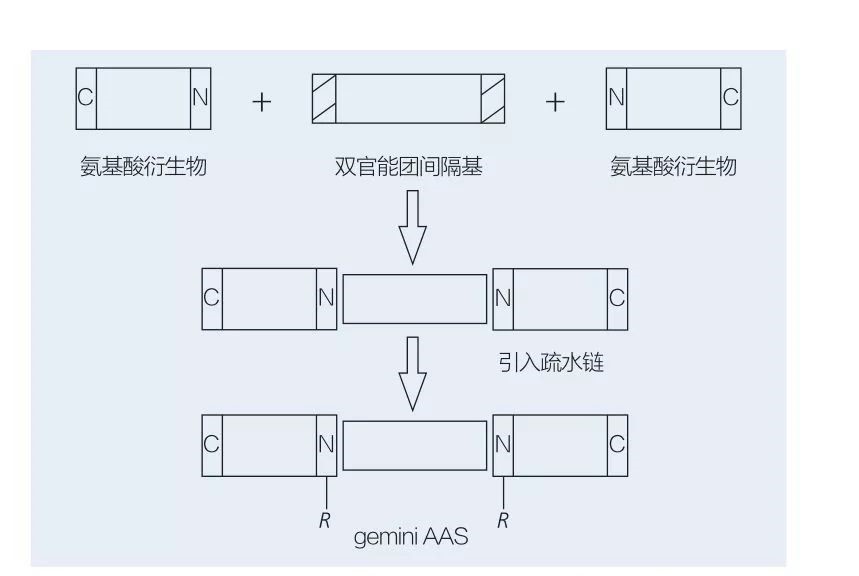
الشكل 6 توليف الجوزاء AAS باستخدام مشتقات AA وفراف ، تليها إدخال المجموعة مسعور
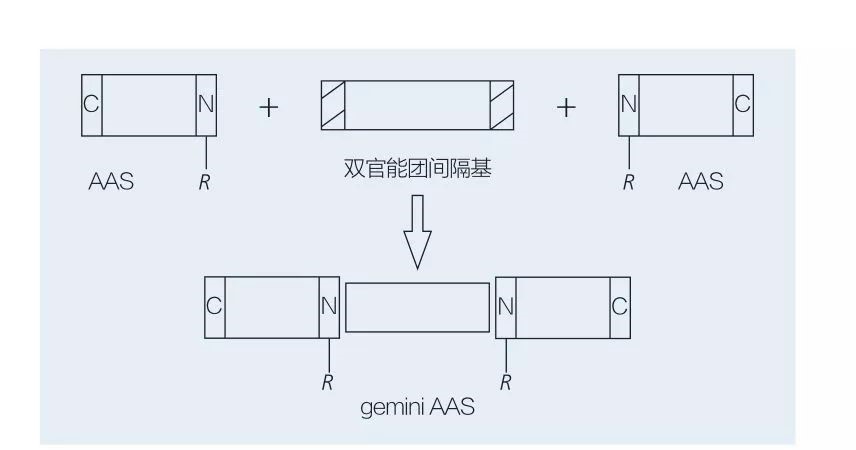
الشكل 7 توليف الجوزاء aass باستخدام فاصل ثنائي الوظيفة و AAS
5.2.3 تخليق حمض الأميني/الببتيد الجلسريوليبيد
الجلسرين الأحماض الأمينية/الببتيد السطحي هي فئة جديدة من الأحماض الأمينية الدهنية التي هي نظائر هيكلية من استرات الجلسرين أحادية (أو دي-) والفوسفوليبيدات ، بسبب هيكلها من سلاسل أو سلاسل دهنية واحدة مع حمض أميني واحد مرتبط بتربية الجليسرين. يبدأ تخليق هذه السطحي بإعداد استرات الجلسرين للأحماض الأمينية في درجات حرارة مرتفعة وفي وجود محفز حمضي (مثل BF 3). يعد توليف الإنزيم المحفز (باستخدام هيدروليز ، والبروتياز والليبتات كعوامل الحفازة) أيضًا خيارًا جيدًا (الشكل 8).
تم الإبلاغ عن توليف الإنزيم المحفز للانزيم من مقارنات أرجينين جليسرينات باستخدام Papain. كما تم الإبلاغ عن توليف من أسيتيلرجينين من أسيتيل أرجينين وتقييم خصائصها الفيزيائية والكيميائية.
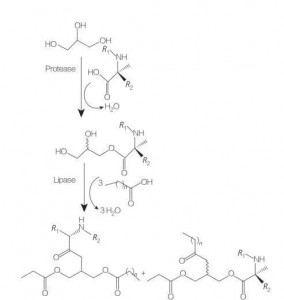
الشكل 8 توليف أحادي واتاكيل جلسرين الأحماض الأمينية
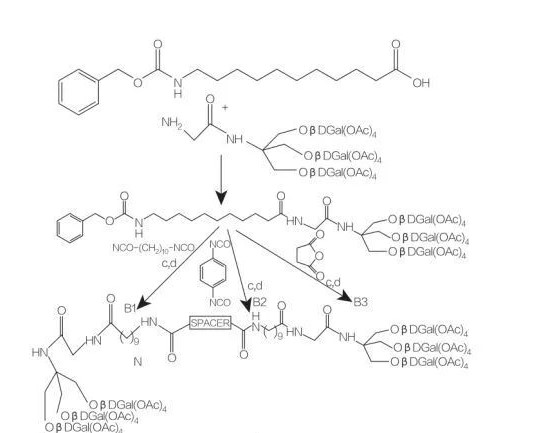
فاصل: NH- (الفصل2)10-NH: COMPOUNDB1
فاصل: NH-C6H4-NH: COMPOUNDB2
فاصل: الفصل2-ل2: CompoundB3
الشكل 9 توليف من الأمفيفيل المتماثل المشتقة من تريس (هيدروكسي ميثيل) أمينوميثان
5.2.4 تخليق السطحي الأحماض الأمينية/الببتيد القائمة على بولا
تحتوي أمفيفيل بولا القائمة على الأحماض الأمينية التي تحتوي على أحماض أمينية مرتبطة بنفس السلسلة مسعور. فرانشيشي وآخرون. وصف تخليق أمفيفيل من نوع بولا مع 2 من الأحماض الأمينية (D أو L-Alanine أو L-histidine) وسلسلة ألكيل واحدة من أطوال مختلفة والتحقيق في نشاطها السطحي. يناقشون توليف وتجميع أمفيفيل من نوع بولا الجديد مع جزء من الأحماض الأمينية (باستخدام إما حمض الأميني غير المألوف أو الكحول) ومجموعة فاصل C12 -C20. يمكن أن تكون الأحماض الأمينية غير المألوفة المستخدمة من السكر الأمينية ، وأحماض الأميدوثمين (AZT) ، وأحماض أمينية نوربورن ، وكحول أميني مشتق من AZT (الشكل 9). توليف أمفيفيل من نوع بولا المتماثل المستمدة من تريس (هيدروكسي ميثيل) الأمينوثان (TRIS) (الشكل 9).
06 الخصائص الفيزيائية والكيميائية
من المعروف جيدًا أن السطحي القائم على الأحماض الأمينية (AAS) متنوعة ومتعددة الاستخدامات في الطبيعة ولديها قابلية تطبيق جيدة في العديد من التطبيقات مثل الذوبان الجيد ، وخصائص المستحلب الجيدة ، والكفاءة العالية ، وأداء النشاط السطحي العالي ، ومقاومة النية للمياه العسكرية (تحمل أيون الكالسيوم).
استنادًا إلى خصائص الفاعل السطحي للأحماض الأمينية (مثل التوتر السطحي ، CMC ، سلوك الطور ودرجة حرارة Krafft) ، تم التوصل إلى الاستنتاجات التالية بعد دراسات مكثفة - النشاط السطحي لـ AAS يتفوق على نظيره التقليدي الفاعل بالسطح.
6.1 تركيز micelle الحرج (CMC)
يعد تركيز micelle الحرجة أحد المعلمات المهمة للفاعل السطحي ويحكم العديد من الخصائص النشطة السطحية مثل الذوبان ، وتحلل الخلايا وتفاعلها مع الأغشية الحيوية ، وما إلى ذلك بشكل عام ، يؤدي زيادة طول سلسلة ذيل الهيدروكربون (زيادة الكاتبة) إلى انخفاض في قيمة CMC في محلول السطح الفاتح. عادةً ما يكون للقطاع السطحي القائم على الأحماض الأمينية قيم CMC أقل مقارنة بالفاعلات السطحي التقليدية.
من خلال مجموعات مختلفة من مجموعات الرأس والذيل مسعور (أميد أحادي ، أميد ثنائي ، أميد ثنائي الأميد) ، Infante et al. تم تصنيع ثلاثة AAS المستندة إلى الأرجينين ودرس CMC و γCMC (التوتر السطحي في CMC) ، مما يدل على أن قيم CMC و γCMC انخفضت مع زيادة طول الذيل مسعور. في دراسة أخرى ، وجد Singare و Mhatre أن CMC من السطحي N-as-acylarginine انخفض مع زيادة عدد ذرات الكربون الذيل مسعور (الجدول 1).
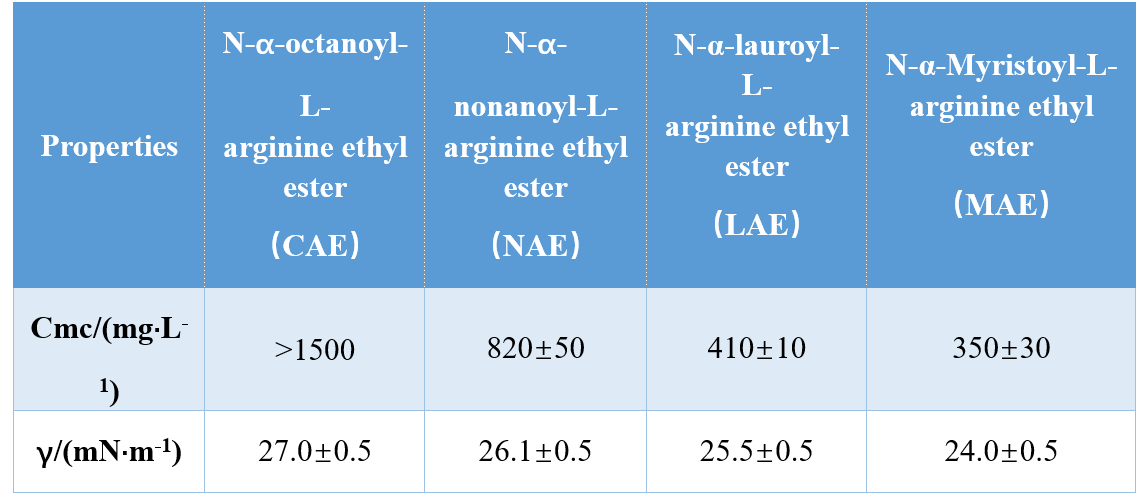
يوشيمورا وآخرون. التحقيق في CMC من السطحي الجوزاء القائم على الأحماض الأمينية القائمة على السيستين وأظهرت أن CMC انخفض عندما زاد طول سلسلة الكربون في السلسلة مسعور من 10 إلى 12. زيادة طول سلسلة الكربون إلى 14 نتجت عن زيادة في CMC ، والتي أكدت أن السلطات الجيمينية طويلة السلسلة لها ميل أقل إلى Agggate.
فاوستو وآخرون. ذكرت تشكيل micelles المختلطة في المحاليل المائية من السطحي الجوزاء الأنيوني القائم على السيستين. وتمت مقارنة السطحي السطحي الجوزاء مع السطحي الأحادي التقليدية المقابلة (C 8 Cys). تم الإبلاغ عن قيم CMC لمخاليط الخلف الدهنية لتكون أقل من تلك الموجودة في السطحي النقي. السطحي الجوزاء و 1،2-diheptanoyl-sn-glyceryl-3-phosphocholine ، وهو فسفوليبيد قابل للذوبان في الماء ، ويشكل ميخيل ، CMC في مستوى الميليمولار.
قام شريستا وأراماكي بالتحقيق في تكوين micelles الشبيهة بالديدان اللزجة في المحاليل المائية للقطاع السطحي غير المميت غير القائم على الأحماض الأمينية في غياب أملاح الاختلاط. في هذه الدراسة ، تم العثور على غلوتامات N-dodecyl لديها درجة حرارة Krafft أعلى. ومع ذلك ، عندما يتم تحييدها مع الأحماض الأمينية الأساسية L-lysine ، فإنها تولد micelles وبدأ المحلول يتصرف مثل السائل النيوتوني عند 25 درجة مئوية.
6.2 قابلية ذوبان المياه الجيدة
إن ذوبان المياه الصالح في AAS يرجع إلى وجود روابط إضافية Co-NH. هذا يجعل AAS أكثر قابلية للتحلل وصديق للبيئة من السطحي التقليدي المقابل. إن قابلية ذوبان الماء في حمض N-acyl-l-glutamic أفضل بسبب مجموعتها من الكربوكسيل. إن قابلية ذوبان الماء في CN (CA) 2 جيدة أيضًا لأن هناك مجموعتان من الأرجينين الأيوني في جزيء واحد ، مما يؤدي إلى امتصاص أكثر فعالية وانتشار في واجهة الخلية وحتى تثبيط بكتيري فعال في تركيزات أقل.
6.3 درجة حرارة Krafft و Krafft Point
يمكن فهم درجة حرارة Krafft على أنها سلوك الذوبان المحدد للمواد الفاعلة السطحي التي يزداد قابلية ذوبانها بشكل حاد أعلى من درجة حرارة معينة. السطحي الأيوني لديهم ميل لتوليد هيدرات صلبة ، والتي يمكن أن تترسب من الماء. في درجة حرارة معينة (ما يسمى درجة حرارة Krafft) ، عادة ما يتم ملاحظة زيادة هائلة وغير متوقفة في قابلية سطحية السطحي. نقطة Krafft من الفاعل بالسطح الأيوني هي درجة حرارة Krafft في CMC.
عادةً ما تُرى خاصية القابلية للذوبان هذه بالنسبة إلى السطحي الأيوني ويمكن تفسيرها على النحو التالي: إن قابلية ذوبان المونومر الخالي من الفاعل بالسطح محدود تحت درجة حرارة Krafft حتى يتم الوصول إلى نقطة Krafft ، حيث تزداد قابليتها للذوبان تدريجياً بسبب تكوين الميكرول. لضمان قابلية الذوبان التام ، من الضروري إعداد تركيبات السطح في درجات حرارة أعلى من نقطة Krafft.
تمت دراسة درجة حرارة Krafft في AAS ومقارنتها مع تلك الموجودة في السطحي الاصطناعي التقليدي. درس شريستا وأراماكي درجة حرارة Krafft من AAs القائم على أرجينين ووجدت أن تركيز Micelle الحرج (Ohta et al. N-Hexadecanoyl AAS وناقش العلاقة بين درجة حرارة Krafft وبقايا الأحماض الأمينية.
في التجارب ، تبين أن درجة حرارة Krafft لـ N-hexadecanoyl AAs زادت مع انخفاض حجم بقايا الأحماض الأمينية (كون فينيل ألانين استثناء) ، في حين زادت حرارة القابلية للذوبان (امتصاص الحرارة) مع انخفاض حجم بقايا الأحماض الأمينية (باستثناء الجليسين والفينيلالانين). وخلص إلى أنه في كل من أنظمة Alanine و Phenylalanine ، يكون تفاعل DL أقوى من تفاعل LL في الشكل الصلب لملح N-hexadecanoyl AAS.
Brito et al. حددت درجة حرارة Krafft لثلاث سلسلة من السطحي القائم على الأحماض الأمينية الجديدة باستخدام القياس الدقيق للمسح التفاضلي ووجدت أن تغيير أيون ثلاثي فلورو أسيتات إلى أيون يوديد أدى إلى زيادة كبيرة في درجة حرارة Krafft (حوالي 6 درجة مئوية) ، من 47 درجة مئوية إلى 53 درجة مئوية. أدى وجود روابط ثنائية الدولابية والتشبع الموجود في المتسابقات الطويلة للسلسلة الطويلة إلى انخفاض كبير في درجة حرارة Krafft. تم الإبلاغ عن أن غلوتامات N-dodecyl لديها درجة حرارة أعلى Krafft. ومع ذلك ، أدى التحييد مع الأحماض الأمينية الأساسية L-lysine إلى تكوين micelles في محلول يتصرف مثل السوائل النيوتونية عند 25 درجة مئوية.
6.4 التوتر السطحي
يرتبط توتر السطح السطحي بطول سلسلة الجزء مسعور. تشانغ وآخرون. حدد التوتر السطحي لـ Cocoyl Glycinate بواسطة طريقة لوحة Wilhelmy (25 ± 0.2) ° C وتحديد قيمة التوتر السطحي في CMC كـ 33 MN -M -1 ، CMC مثل 0.21 mmol -L -1. يوشيمورا وآخرون. حدد التوتر السطحي للتوتر السطحي السطحي القائم على الأحماض الأمينية 2C N من العوامل النشطة السطحية القائمة على السطح 2C. وقد وجد أن التوتر السطحي عند CMC انخفض مع زيادة طول السلسلة (حتى ن = 8) ، في حين تم عكس الاتجاه للسلاح السطحي بأطوال سلسلة N = 12 أو أطول.
كما تمت دراسة تأثير CAC1 2 على التوتر السطحي لسطح السطح القائم على الأحماض الأمينية ديكاروكسيل. في هذه الدراسات ، تمت إضافة CAC1 2 إلى المحاليل المائية لثلاث سطحي من نوع الحمض الأميني من نوع الكربوكسيل (C12 MALNA 2 ، C12 ASPNA 2 ، و C12 GLUNA 2). تمت مقارنة قيم الهضبة بعد CMC ووجد أن التوتر السطحي انخفض بتركيزات CAC1 2 منخفضة للغاية. هذا بسبب تأثير أيونات الكالسيوم على ترتيب السطحي في واجهة المياه الغازية. كانت التوترات السطحية لأملاح N-dodecylaminomalonate و N-Dodecylaspartatt ، من ناحية أخرى ، ثابتة تقريبًا حتى 10 مللي مول-L -1 CAC1 2. أعلى من 10 مليمول -لتر -1 ، يزداد التوتر السطحي بشكل حاد ، بسبب تكوين هطول أمطار ملح الكالسيوم في السطحي. بالنسبة إلى ملح الغلوتامات N-dodecyl ، أدت الإضافة المعتدلة لـ CAC1 2 إلى انخفاض كبير في التوتر السطحي ، في حين لم تعد زيادة تركيز CAC1 2 تسبب في تغييرات كبيرة.
لتحديد حركية الامتزاز لـ AAS من نوع Gemini-type في واجهة المياه الغازية ، تم تحديد التوتر السطحي الديناميكي باستخدام طريقة ضغط الفقاعة القصوى. أظهرت النتائج أنه لأطول وقت اختبار ، لم يتغير توتر السطح الديناميكي 2C 12 Cys. يعتمد انخفاض التوتر السطحي الديناميكي فقط على التركيز وطول ذيول الكارهة للماء وعدد ذيول الكارهة للماء. زيادة تركيز الفاعل بالسطح ، مما أدى إلى انخفاض طول السلسلة وكذلك عدد السلاسل في تسوس أسرع. تم العثور على النتائج التي تم الحصول عليها لتركيزات أعلى من c n cys (n = 8 إلى 12) لتكون قريبة جدا من cmc cmc المقاسة بواسطة طريقة فيلهيلمي.
في دراسة أخرى ، تم تحديد التوترات السطحية الديناميكية لسيستين الصوديوم (SDLC) وسيستين الصوديوم Didecamino بواسطة طريقة لوحة الفيلهيلمي ، بالإضافة إلى ذلك ، تم تحديد توترات سطح التوازن في محاليلها المائية بواسطة طريقة حجم الإسقاط. تم التحقيق في تفاعل روابط ثاني كبريتيد بطرق أخرى أيضًا. أدت إضافة Mercaptoethanol إلى 0.1 mmol -l -1SDLC إلى زيادة سريعة في التوتر السطحي من 34 Mn -M -1 إلى 53 Mn -M -1. نظرًا لأن NaClo يمكن أن يؤكسد روابط ثاني كبريتيد SDLC إلى مجموعات حمض السلفونيك ، لم يلاحظ أي مجاميع عندما تمت إضافة NaClo (5 mmol -L -1) إلى محلول SDLC 0.1 Mmol -L -1. أظهرت المجهر الإلكتروني للإرسال ونتائج نثر الضوء الديناميكي أنه لم يتم تشكيل مجاميع في المحلول. تم العثور على توتر السطح من SDLC لزيادة من 34 MN -M -1 إلى 60 MN -M -1 خلال فترة 20 دقيقة.
6.5 التفاعلات السطحية الثنائية
في علوم الحياة ، درس عدد من المجموعات الخصائص الاهتزازية لمخاليط AAs الكاتيونية (السطحي القائم على الأرجينين Diacylglycerol) والفوسفوليبيد في واجهة مياه الغاز ، وتخلص أخيرًا إلى أن هذه الخاصية غير العادية تسبب انتشار التفاعلات الإلكتروستاتيكية.
6.6 خصائص التجميع
يستخدم نثر الضوء الديناميكي بشكل شائع لتحديد خصائص التجميع للمونومرات القائمة على الأحماض الأمينية والسطحي الجوزاء بتركيزات فوق CMC ، مما يؤدي إلى قطر الهيدروديناميكي الظاهر DH (= 2R H). المجاميع التي تشكلها C N Cys و 2CN Cys كبيرة نسبيا ولها توزيع واسع النطاق مقارنة مع السطحي الأخرى. جميع السطحي باستثناء 2C 12 Cys تشكل مجاميع من حوالي 10 نانومتر. أحجام micelle من السطحي الجوزاء أكبر بكثير من أحجام نظرائهم أحادية. تؤدي زيادة طول سلسلة الهيدروكربونات أيضًا إلى زيادة في حجم micelle. Ohta et al. وصفت خصائص التجميع لثلاثة أجهزة استريو مختلفة من رباعي ميثيل الأميثيل في فينيل ألينيل-ألينيل فينيل الألانين في محلول مائي وأظهرت أن دياستيرومرات لها نفس تركيز الاعتماد الهام في محلول مائي. Iwahashi et al. التحقيق في التبلور الدائري ، الرنين المغناطيسي النووي وضغط البخار osmometry. dichroism الدائري ، الرنين المغناطيسي النووي والبخار ضغط osmometry.
6.7 الامتزاز البيني
يعد امتصاص السطحي القائم على الأحماض الأمينية ومقارنته مع نظيره التقليدي أحد اتجاهات البحث. على سبيل المثال ، تم التحقيق في خصائص الامتزاز البيني لإسترات دوديسيل للأحماض الأمينية العطرية التي تم الحصول عليها من LET و LEP. أظهرت النتائج أن LET و LEP أظهرت مناطق انتقائية أقل في واجهة الغاز السائل وفي واجهة الماء/الهكسان ، على التوالي.
Bordes et al. التحقيق في سلوك الحل والامتصاص في واجهة المياه الغازية لثلاثة سطحيات من الأحماض الأمينية dicarboxylated ، وأملاح desodium من الغلوتامات دوديسيل ، ودوديسيل الأسبارتات ، والأمينومالونات (مع 3 و 2 و 1 ذرات الكربون بين مجموعتي الكربوكسيل ، على التوالي). وفقا لهذا التقرير ، كان CMC من السطحي dicarboxylated أعلى 4-5 مرات من ملح ملح دوديسيل جليكاين. ويعزى ذلك إلى تكوين روابط الهيدروجين بين السطحي dicarboxylated والجزيئات المجاورة من خلال مجموعات أميد فيها.
6.8 سلوك المرحلة
ويلاحظ مراحل مكعب متقطعة الخواص بالنسبة للسطح بتركيزات عالية جدا. تميل جزيئات الفاعل السطحي مع مجموعات الرأس الكبيرة جدًا إلى تكوين مجاميع من الانحناء الإيجابي الأصغر. ماركيز وآخرون. درس سلوك الطور في أنظمة 12LYS12/12SER و 8LOS8/16SER (انظر الشكل 10) ، وأظهرت النتائج أن نظام 12LYS12/12SER له منطقة فصل الطور بين نظام MICELLAR و SELTICAL SOLITION و FESICALE و FESECLE Praition و FESELAR MICELLAR. منطقة). تجدر الإشارة إلى أنه بالنسبة لمنطقة الحويصلة في نظام 12LYS12/12SER ، تتعايش الحويصلات دائمًا مع micelles ، في حين أن منطقة الحويصلة في نظام 8LYS8/16SER لها حويصلات فقط.
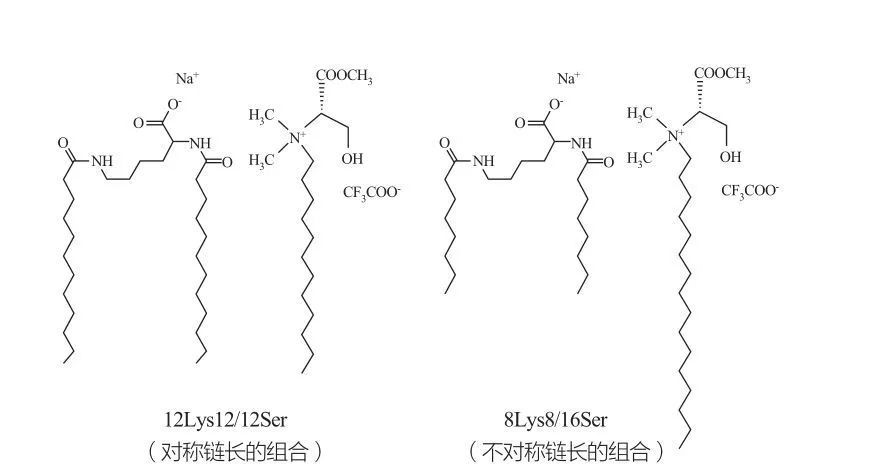
مخاليط كاتانيون من السطحي القائم على ليسين وسيرين: زوج متماثل 12lys12/12Ser (يسار) وزوج 8lys8/16Ser غير المتماثل (يمين)
6.9 القدرة على المستحلب
Kouchi et al. فحص قدرة المستحلب ، والتوتر البيني ، والتشتت ، ولزوجة N- [3-dodecyl-2-hydroxypropyl] -l-arginine ، l-glutamate ، وغيرها من AAs. بالمقارنة مع السطحي الاصطناعي (نظيراتها التقليدية غير اليدوية والأمفوترية) ، أظهرت النتائج أن AAS لديها قدرة على المستحلب أقوى من السطحي التقليدي.
Baczko et al. تصنيع السطحي الحمض الأميني الأنيوني الجديد والتحقيق في مدى ملاءمتها باعتبارها مذيبات التحليل الطيفي الرنين المغناطيسي النووي الموجه. تم تصنيع سلسلة من مشتقات L-PHE أو L-ALA القائمة على السلفونات مع ذيول مسعور مختلفة (Pentyl ~ tetradecyl) عن طريق تفاعل الأحماض الأمينية مع أنهيدريد O-sulfobenzoic. وو وآخرون. توليف أملاح الصوديوم من N-fatty Aas والتحقيق في قدرتها على المستحلب في مستحلبات الزيت في المياه ، وأظهرت النتائج أن هذه السطحي أداء أفضل مع خلات إيثيل كمرحلة الزيت من مع N-hexane كطرح الزيت.
6.10 التقدم في التوليف والإنتاج
يمكن فهم مقاومة الماء العسر على أنها قدرة السطحي على مقاومة وجود أيونات مثل الكالسيوم والمغنيسيوم في الماء العسر ، أي القدرة على تجنب هطول الأمطار في صابون الكالسيوم. السطحي مع مقاومة عالية من الماء العظيم مفيدة للغاية لتركيبات المنظفات ومنتجات العناية الشخصية. يمكن تقييم مقاومة الماء العسر عن طريق حساب التغير في قابلية الذوبان والنشاط السطحي للسطح في وجود أيونات الكالسيوم.
هناك طريقة أخرى لتقييم مقاومة الماء العسر وهي حساب النسبة المئوية أو غرامات الفاعل بالسطح المطلوبة لصابون الكالسيوم الذي يتكون من 100 غرام من أوليت الصوديوم ليتم تفريقه في الماء. في المناطق ذات الماء العسر العالي ، يمكن أن تجعل التركيزات العالية من أيونات الكالسيوم والمغنيسيوم والمحتوى المعدني بعض التطبيقات العملية صعبة. في كثير من الأحيان يتم استخدام أيون الصوديوم باعتباره أيون مضاد للسلاح السطحي الأنيوني الاصطناعي. نظرًا لأن أيون الكالسيوم ثنائي التكافؤ يرتبط بكلا جزيئات الفاعل بالسطح ، فإنه يتسبب في ترسب الفاعل بالسطح بسهولة أكبر من المحلول مما يجعل المنظفات أقل احتمالًا.
أظهرت دراسة مقاومة الماء العسر في AAS أن مقاومة الحمض والماء العسر تأثرت بشدة بمجموعة إضافية من الكربوكسيل ، وزادت مقاومة الحمض والماء العسر مع زيادة طول مجموعة الفاصل بين مجموعتي الكربوكسيل. كان ترتيب حمض ومقاومة الماء العسر C 12 Glycinate <C 12 Aspartate <C 12 glutamate. مقارنة بين رابطة أميد dicarboxylated و dicarboxylated السطحي الأميني ، على التوالي ، وجد أن نطاق الأس الهيدروجيني من هذا الأخير كان أوسع وزيادة نشاطه السطحي مع إضافة كمية مناسبة من الحمض. أظهرت الأحماض الأمينية N-alkyl dicarboxylated تأثيرها المخلل في وجود أيونات الكالسيوم ، وهلام أسبارتات أسبارتات. أظهر C 12 Glutamate نشاطًا مرتفعًا على السطح عند تركيز Ca 2+ المرتفع ومن المتوقع استخدامه في تحلية مياه البحر.
6.11 التشتت
يشير التشتت إلى قدرة الفاعل بالسطح على منع الاندماج والترسيب للسطح في الحل.تشتت التشتت هي خاصية مهمة للقطاعات السطحي التي تجعلها مناسبة للاستخدام في المنظفات ومستحضرات التجميل والمستحضرات الصيدلانية.يجب أن يحتوي عامل التشتت على الرابطة أو الأثير أو الأميد أو الأمينية بين المجموعة المائية والمجموعة المحببة المحلية (أو بين المجموعات المائية المستقيمة).
بشكل عام ، فإن السطحي الأنيوني مثل كبريتات الكانولاميدو والقطاعات السطحية الأمفوترية مثل Amidosulfobetaine هي فعالة بشكل خاص كعوامل تشتت لصابون الكالسيوم.
لقد حددت العديد من الجهود البحثية تشتت AAS ، حيث تم العثور على N-Lauroyl Lysine لتكون متوافقة بشكل جيد مع الماء وصعوبة استخدامها لتركيبات مستحضرات التجميل.في هذه السلسلة ، تتمتع الأحماض الأمينية الأساسية N-acyl بتشتت رائع وتستخدم في صناعة مستحضرات التجميل لتحسين المستحضرات.
07 السمية
السطحي التقليدي ، وخاصة السطحي الكاتيوني ، شديدة السمية للكائنات المائية. تسببت سمية الحادة في ظاهرة التفاعل بين الامتزاز في أيون في واجهة المياه الخلوية. يؤدي تقليل CMC من المواد السطحية عادة إلى امتصاص أقوى بين السطحي ، مما يؤدي عادة إلى سمية حادة مرتفعة. تؤدي زيادة في طول سلسلة السطحي مسعورًا أيضًا إلى زيادة في السمية الحادة الفاعل بالسطح.معظم AAs منخفضة أو غير سامة للبشر والبيئة (وخاصة للكائنات البحرية) وهي مناسبة للاستخدام كمكونات غذائية وصيدلاني ومستحضرات التجميل.لقد أثبت العديد من الباحثين أن السطحي في الأحماض الأمينية لطيفة وغير مريرة للجلد. من المعروف أن الفاعل بالسطح القائم على أرجينين أقل سمية من نظرائهم التقليديين.
Brito et al. درس الخصائص الفيزيائية والكيميائية السمية للأمفيفيلات القائمة على الأحماض الأمينية و [مشتقاتها من التيروزين (TYR) ، هيدروكسي برولين (HYP) ، سيرين (SER) و Lysine (LYS)] تكوين عفوي للحلقات الكاتيونية واعطى بيانات عن السمية الحادة إلى Daphnia Magna (IC 50). قاموا بتوليف الحويصلات الكاتيونية من بروميد دوديسيلي تيريميثيل الأمونيوم (DTAB)/مشاركات LYS و/أو مخاليط المصل/المصلحة واختبرت السمية البيئية وإمكانية انحلالها ، مما يدل على أن جميع الخلطات AAS ومخليطها الحويصات أقل سمية من DTAB التقليدية.
روزا وآخرون. التحقيق في الربط (الارتباط) من الحمض النووي للحويصلات الكاتيونية القائمة على الأحماض الأمينية المستقرة. على عكس السطحي الكاتيوني التقليدي ، والذي يبدو غالبًا ما يكون سامًا ، يبدو أن تفاعل السطحي في الأحماض الأمينية الكاتيونية غير سامة. يعتمد AAS الكاتيوني على أرجينين ، والذي يشكل تلقائيًا حويصلات مستقرة مع بعض السطحي الأنيوني. كما تم الإبلاغ عن مثبطات التآكل القائمة على الأحماض الأمينية غير سامة. يتم تصنيع هذه السطحي بسهولة مع نقاء مرتفع (تصل إلى 99 ٪) ، وتكلفة منخفضة ، وقابلة للتحلل بسهولة ، وذاتية تمامًا في الوسائط المائية. وقد أظهرت العديد من الدراسات أن السطحي الأحماض الأمينية المحتوية على الكبريت متفوقة في تثبيط التآكل.
في دراسة حديثة ، Perinelli et al. أبلغت عن صورة سمية مرضية من rhamnolipids مقارنة مع السطحي التقليدي. من المعروف أن rhamnolipids بمثابة معززات للنفاذية. كما أبلغوا عن تأثير rhamnolipids على نفاذية الظهارية للأدوية الجزيئية.
08 النشاط المضاد للميكروبات
يمكن تقييم النشاط المضاد للميكروبات من السطحي عن طريق الحد الأدنى للتركيز المثبط. تمت دراسة النشاط المضاد للميكروبات من السطحي القائم على أرجينين بالتفصيل. تم العثور على البكتيريا سالبة الجرام لتكون أكثر مقاومة للقطاع السطحي القائم على الأرجينين من البكتيريا الإيجابية للجرام. عادة ما يتم زيادة النشاط المضاد للميكروبات من السطحي من خلال وجود هيدروكسيل أو روابط سيكلوبروبان أو غير مشبعة داخل سلاسل الأسيل. كاستيلو وآخرون. أظهر أن طول سلاسل الأسيل والشحنة الإيجابية يحدد قيمة HLB (التوازن المائي المحبب) للجزيء ، وأنها لها تأثير على قدرتها على تعطيل الأغشية. Nα-acylarginine ميثيل استر هي فئة أخرى مهمة من السطحي الكاتيوني مع نشاط مضاد للميكروبات واسعة الطيف ، وهو قابل للتحلل بسهولة وله سمية منخفضة أو لا. دراسات على تفاعل السطحي Nα-acylarginine ميثيل المستندة إلى استر مع 1،2-dipalmitoyl-sn-propyltrioxyl-3-phosphorylcholine و 1،2-ditetradecanoyl-sn-propyltiroxyl-3-phosphorylline ، modernes masships ، و expans of than than in in in ins ins ans ans ansan السطحي لديه مضادات الميكروبات جيدة وأظهرت النتائج أن السطحي لديهم نشاط مضاد للبكتيريا جيد.
09 الخصائص الريولوجية
تلعب الخصائص الريولوجية للسلاح السطحي دورًا مهمًا للغاية في تحديد تطبيقاتها والتنبؤ بها في الصناعات المختلفة ، بما في ذلك الأغذية والمستحضرات الصيدلانية واستخراج النفط والعناية الشخصية ومنتجات الرعاية المنزلية. وقد أجريت العديد من الدراسات لمناقشة العلاقة بين اللزوجة من السطحي الأحماض الأمينية و CMC.
10 تطبيقات في صناعة مستحضرات التجميل
تستخدم AAS في صياغة العديد من منتجات العناية الشخصية.تم العثور على البوتاسيوم n-cocoyl glycinate ليكون لطيف على الجلد ويستخدم في تطهير الوجه لإزالة الحمأة والمكياج. يحتوي حمض N-acyl-L-glutamic على مجموعتين من الكربوكسيل ، مما يجعله أكثر قابلة للذوبان في الماء. من بين هذه AAS ، تستخدم AAS على أساس الأحماض الدهنية C 12 على نطاق واسع في تطهير الوجه لإزالة الحمأة والمكياج. يتم استخدام AAS مع سلسلة C 18 كمستحلبات في منتجات العناية بالبشرة ، ومن المعروف أن أملاح N-lauryl Alanine تخلق رغبات كريمية لا تزعج الجلد وبالتالي يمكن استخدامها في صياغة منتجات رعاية الأطفال. AAS المستندة إلى N-Lauryl المستخدمة في معجون الأسنان لديها منظفات جيدة مماثلة للصابون وفعالية مثبتة الإنزيم القوية.
على مدار العقود القليلة الماضية ، ركز اختيار السطحي على مستحضرات التجميل ومنتجات العناية الشخصية والمستحضرات الصيدلانية على السمية المنخفضة ، والطخور ، واللطف إلى اللمس والسلامة. يدرك المستهلكون من هذه المنتجات تمامًا التهيج المحتملة والسمية والعوامل البيئية.
اليوم ، يتم استخدام AAS لصياغة العديد من الشامبو وأصباغ الشعر وصابون الحمام بسبب العديد من مزاياها على نظرائهم التقليدية في مستحضرات التجميل ومنتجات العناية الشخصية.السطحي القائم على البروتين لديها خصائص مرغوبة ضرورية لمنتجات العناية الشخصية. بعض AAS لديها قدرات تشكيل الأفلام ، في حين أن البعض الآخر لديه قدرات رغوة جيدة.
الأحماض الأمينية مهمة عوامل ترطيب تحدث بشكل طبيعي في طبقة القرنية. عندما تموت خلايا البشرة ، تصبح جزءًا من القرنية الطبقية ويتم تدهور البروتينات داخل الخلايا تدريجياً إلى الأحماض الأمينية. ثم يتم نقل هذه الأحماض الأمينية إلى أبعد من ذلك إلى القرنية الطبقية ، حيث تمتص المواد الدهنية أو الشبيهة بالدهون في قرنية طبقة البشرة ، مما يحسن مرونة سطح الجلد. يتكون حوالي 50 ٪ من عامل الترطيب الطبيعي في الجلد من الأحماض الأمينية والبيروليدون.
يحتوي الكولاجين ، وهو مكون من مستحضرات التجميل الشائعة ، أيضًا على أحماض أمينية تبقي الجلد ناعمة.ترجع مشاكل الجلد مثل الخشونة والبلاء إلى حد كبير إلى نقص الأحماض الأمينية. أظهرت إحدى الدراسات أن مزج الأحماض الأمينية مع مرهم محروق الجلد ، وعادت المناطق المتأثرة إلى حالتها الطبيعية دون أن تصبح ندوبًا.
كما تم العثور على الأحماض الأمينية لتكون مفيدة للغاية في رعاية البشرة التالفة.قد يشير الشعر الجاف الذي لا يشكل شكله إلى انخفاض في تركيز الأحماض الأمينية في قرنية طبقة تضررت بشدة. الأحماض الأمينية لديها القدرة على اختراق بشرة في رمح الشعر وتمتص الرطوبة من الجلد.هذه القدرة على السطح السطحي القائم على الأحماض الأمينية تجعلها مفيدة للغاية في الشامبو ، وأصبغات الشعر ، ومطبقات الشعر ، ومكيفات الشعر ، ووجود الأحماض الأمينية يجعل الشعر قويًا.
11 تطبيق في مستحضرات التجميل اليومية
حاليًا ، هناك طلب متزايد على تركيبات المنظفات القائمة على الأحماض الأمينية في جميع أنحاء العالم.من المعروف أن AAS لديها قدرة على التنظيف بشكل أفضل وقدرة الرغوة وخصائص تليين القماش ، مما يجعلها مناسبة للمنظفات المنزلية والشامبو وغسل الجسم والتطبيقات الأخرى.تم الإبلاغ عن أن AAS الأمفوترية المستمدة من حمض الأسبارتيك هو منظف فعال للغاية مع خصائص مخبأة. تم العثور على استخدام مكونات المنظفات التي تتكون من أحماض N-alkyl-β-aminoethoxy للحد من تهيج الجلد. تم الإبلاغ عن صياغة المنظفات السائلة التي تتكون من N-cocoyl-β-aminopropionate أنها منظف فعال لبقع الزيت على الأسطح المعدنية. كما تبين أيضًا أن السطحي بحمض أمينوكبوكسيليك ، C 14 Chohch 2 NHCH 2 Coona ، يتمتع بمنظفات أفضل ويستخدم لتنظيف المنسوجات والسجاد والشعر والزجاج ، إلخ. ومن المعروف أن 2-هيدروكسي -3-أمينوبروبيون حمض الحمض N-Acetoacetic معروف بأنه يتمتع بقدرة جيدة على التعقيد.
تم الإبلاغ عن تحضير تركيبات المنظفات القائمة على N- (N'ong-chain acyl-al-alanyl)-β-alanine بواسطة Keigo و Tatsuya في براءة الاختراع لتحسين قدرة الغسيل والاستقرار ، وكسر الرغوة السهل وتليين النسيج الجيد. طورت KAO صياغة منظفات تعتمد على N-AACEL-1 -N-Hydroxy-β-Alanine وأبلغت عن تهيج الجلد المنخفض ، ومقاومة عالية للماء ، وقوة إزالة وصمة عار عالية.
تستخدم الشركة اليابانية Ajinomoto AAs منخفضة السمية وقابلة للتحلل بسهولة استنادًا إلى حمض L-glutamic ، L-Arginine و L-Lysine كمكونات رئيسية في الشامبو ، المنظفات ومستحضرات التجميل (الشكل 13). كما تم الإبلاغ عن قدرة إضافات الإنزيم في تركيبات المنظفات لإزالة تلوث البروتين. تم الإبلاغ عن N-acyl AAs المستمدة من حمض الجلوتاميك ، والألانين ، والميثيل جليكاين ، والسيرين وحمض الأسبارتيك لاستخدامها كمنظفات سائلة ممتازة في المحاليل المائية. لا تزيد هذه السطحي من اللزوجة على الإطلاق ، حتى في درجات حرارة منخفضة للغاية ، ويمكن نقلها بسهولة من وعاء التخزين لجهاز الرغوة للحصول على رغاوي متجانسة.
وقت النشر: Jun-09-2022

